289. (2/3-95). Найти температурную зависимость константы равновесия физической адсорбции двухатомной молекулы на гладкой плоской поверхности.
290. (3/3-97). Оцените ожидаемую температурную зависимость энтальпии адсорбции бензола на металлическом никеле при температурах выше колебательной температуры молекул бензола.
291. (6/3-05). Запишите с точностью до множителя, как зависит давление водорода над поверхностью металлической меди от температуры и количества адсорбированного водорода, если известно, что адсорбция протекает по механизму Лэнгмюра и адсорбированный атом водорода на поверхности металла локализован? Количество центров адсорбции на поверхности Гs. Теплота адсорбции 80 кДж/моль. Можно полагать, что T << θкол H2.
292. (4/2-94). Найдите температурную зависимость константы равновесия реакции
CO2 = CO + O
в газовой фазе в диапазоне температур 1000–1500 К, если известно, что энергия связи С-О в молекуле СО2 равна 498,7 кДж/моль, длина этой связи равна 0,1167 нм и 0,1128 нм в СО2 и СО соответственно, а частоты колебаний в молекуле СО2 составляют v1 = 1351 см–1, v2 = 2396 см–1, v3 = v4 = 672 см–1, а в молекуле СО – v = 2170 см–1.
Электронные возбуждения частиц не учитывать.
293. (1/3-97).* Используя методы статистической термодинамики, найти температурную зависимость константы равновесия Кр для газофазной диссоциации двухатомной молекулы. Привести график ожидаемого изменения Кр в широкой области температур.
Решение294. (6/3-99). Как зависит от температуры константа равновесия для реакции окисления водорода кислородом в газовой фазе? Получить выражение для зависимости ln(Kp) от Т с точностью до постоянного слагаемого в приближениях θ rot << T << θ vib и θ vib << T << θ el. Корректны ли такие приближения? Считать энергии связи Do298(H–H) = 436 кДж/моль; Do298 (О–H) = 427,5 кДж/моль; Do298(О–О) = 498 кДж/моль.
295. (6/Э-07). Определите аналитический вид температурной зависимости константы равновесия реакции 3 А2 ↔ 2 А3. Известно, что трехатомная молекула A3 имеет нелинейное строение и вклады колебаний в статистические суммы А2 и А3 пренебрежимо малы.
296. (4/3-03). Определить равновесные концентрации орто- и пара-водорода при температурах 50, 100 и 300 К, если известно, что при превращении о-Н2 ® п-Н2 выделяется 1,418 кДж / моль теплоты.
297. (3/3-04) Найти зависимость эффективной мольной теплоёмкости
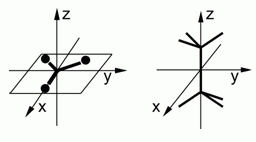 298. (6/3-01). Оценить константу равновесия для реакции C2H6 = 2×
CH3 при 300 К и 1000 К, если известно, что для метильного радикала:
298. (6/3-01). Оценить константу равновесия для реакции C2H6 = 2×
CH3 при 300 К и 1000 К, если известно, что для метильного радикала:
Ix = Iy = 2,5.10–47 кг м2, Iz = 5.10–47кг м2; для этана: Ix = Iy = 40.10–47 кг м2, момент инерции вращения одной –СН3-группы этана относительно оси С–С связи 5.10–47 кг м2. Энергию связи С–С принять равной 300 кДж/моль. Считать, что при 1000 К внутреннее вращение в молекуле этана разморожено. Колебаниями пренебречь.
299. (5/3-02). Рассчитайте константу равновесия Кр реакции диссоциации закиси азота (N2O) на молекулярный азот и атомарный кислород при 1000 К. Энергия диссоциации N2O на N2 и О – 161,3 кДж/моль.
Форма |
Межъядерное расстояние, Å |
Частоты | |
N2O |
N=N–O, |
N=O 1,184 |
2224 |
N2 |
Линейная |
1,10 |
2358 |
300. (6/Э-02). В сосуде постоянного объема в газовой фазе в равновесии находятся изомеры А и В вещества с молекулярной массой М. Температура низкая, так что полные вращательные статсуммы для А и В соответственно равны
Колебательные степени свободы не возбуждены. Перепад энергии основных колебательных уровней для изомеров А и В равен D Ео. Общее число молекул в системе No. Определить кажущуюся теплоемкость системы.
301. (5/3-99). Для реакции H2 + D2
⇔2HD тепловой эффект реакции при абсолютном нуле температур
302. (2/Э-94). При каком давлении молекулярный водород может оказаться диссоциированным наполовину при температуре 500 °С? Известно, что энергия связи Н–Н в молекуле водорода составляет 435,9 кДж/моль, а длина этой связи – 0,741Å. Как изменится результат, если водород будет полностью дейтерированным? Энергию и длину связи в последнем случае считать прежними.
303. (2/3-96). Рассчитать стандартное абсолютное значение энтропии образования газообразного атома кислорода при 298,15 К, пренебрегая спин-орбитальным расщеплением основного уровня. В какую сторону и почему полученный результат будет отличаться от "точного" табличного значения.
304. (6/Э-95). Оценить степень диссоциации газообразной воды по реакции
H2O = H + OH,
при температуре 1000 °С и атмосферном давлении, если известно, что в молекуле воды длина связи О–Н равна 0,0957 нм, валентный угол Н–О–Н 104,5°, энергия ионизации 12,6 эВ, частоты колебаний молекулы ν 1 = 3652 см–1, ν 2 = 1595 см–1 и ν 3 = 3756 см–1. Для О–Н-радикала длина связи О–Н равна 0,097 нм, частота колебаний νО–Н = 3735 см–1, энергия ионизации 4,35 эВ. Возбуждением электронных степеней свободы пренебречь. Энергия разрыва связи О–Н в молекуле Н2О по реакции Н2О = ОН + Н равна 498,7 кДж/моль, а в радикале ОН по реакции ОН = О + Н – 427,8 кДж/моль.
305. (4/3-96). В термостате при стандартных условиях (суммарное давление в термостате 1 атм, температура 298 К) находится один моль идеального газа, способного к диссоциации по реакции
A = 2B.
Газ В тоже идеальный. Молекулярные статсуммы А и В связаны соотношением
ln(zA/
306. (3/3-98). Для реакции диссоциации молекулярного водорода
H2 = 2H
рассчитать константу равновесия KP при Т = 3000 К статистическим методом. rH-H = 0,7 А, θхар = 6300 К, энергия диссоциации Dоо = 350 кДж/моль. Электронным возбуждением пренебречь.
307. (4/3-98). В предварительно откачанный сосуд с 0,25 г силикагеля напустили 1 ммоль D2. Найти равновесный состав газовой фазы и концентрацию поверхностных гидроксильных групп после реакции изотопного обмена. При расчетах пренебречь изотопными эффектами, связанными с различием энергетических и массо-размерных характеристик молекул и молекулярных групп. Концентрация поверхностных ОН-групп на SiO2 8 мкмоль/м2 и не зависит от температуры и давления, удельная площадь поверхности силикагеля 500 м2/г.
308. (2/3-97). Используя методы статистической термодинамики, найти ожидаемое стандартное значение изменения энтропии, а также константу равновесия для реакции дейтерирования бензола
С6Н6 + D2 = С6Н5D + НD
в газовой фазе в области невысоких температур.